
About Laboratory

▼講座研究概要
完全反応を目指して重要医薬品を高純度かつ低コストで大量供給できる合成プ ロセスが、医学、薬学の世界で切実に求められています。当研究室では、周期表にある元素の特徴を活用して、どのような反応基質に対しても例外なく高い収率 、高い選択性を与えるような、完全反応の実現を目指しています。現在は特に、 比較的安価 な典型金属(アルミニウム、ボラン)を中心としたルイス酸触媒を用 いる不斉合成、立体、位置、官能基選択的反応、および高分子合成、天然物合成 に重点をおいて研究開発を行っています。将来的には、薬物効果の分子レベルにおけるメカニズムの解明、あるいはコンビナトリアルライブラリーを用いる効率的な、薬物の発見、触媒の創製なども行っていこうと考えています。


▼研究テーマ
●生理活性物質の新規合成法の開発
●新規生理活性物質の構造と機能の相関関係の解析
●新しい生理機能を持つ低分子化合物の設計
●酵素類似機能を持つ低分子物質のモレキュラーデザイン
●生理活性物質の構造と機能の相関のデータベース化
●バイオミメティックケミストリー
●ドラッグデザイン
▼最近の研究
触媒のスリム化は触媒量の削減に直結する。当研究室では、環境に優しい生体酵素反応に着目し、1万を優に超える分子量からなる酵素タンパクゆえの「環境低負荷条件での高度な触媒機能」を小分子レベルで再現し、それを凌駕する反応プロセスの実現を目指している。小分子の中に酵素類似機能を組み込むために、触媒内に酸と塩基を効果的に配置し、非結合性の化学的相互作用(水素結合、親水力、疎水力、双極子相互作用、π-π電子相互作用など)を巧みに生み出すことが出来れば、酵素レベルの触媒機能制御も可能のはずである。我々は触媒回転効率の向上、原子効率(生成物/原料)の向上、E-ファクター(廃棄物/原料)の低減、毒性化合物削減などの問題に取り組み、真に有効な酸・塩基複合型小分子人工酵素を幾つか開発した。以下、代表的な研究成果を6つ紹介する。



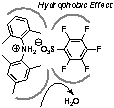
1. Bronsted酸-Lewis塩基複合型脱水縮合触媒
カルボン酸とアルコールの等モル混合物からの脱水縮合触媒として、嵩高い弱塩基性ジアリールアミンと嵩高い弱酸性アレンスルホン酸の有機塩触媒を開発した。本触媒の特長は活性中心のNH2+が3つの嵩高いアリール基によって疎水的な環境内に存在していることであり、その疎水力によって脱水縮合反応が効果的に促進する。従って、副生する水による加水分解は起きない。C6F5SO3Hのような弱酸性スルホン酸との塩はCF3SO3Hのような超強酸との塩よりも疎水的であるため、より高い触媒活性を示す。比較的反応性の高い基質間のエステル縮合反応においては無溶媒、室温の条件でも1 mol%の触媒存在下でエステルと水に変換される。樹脂担持型触媒の開発にも成功し、回収・再利用も実現。触媒設計の鍵は触媒自身の疎水効果であり、この原理は酵素の働きと同じであるが、数百の分子量の触媒で達成出来た点が注目に値する。
K. Ishihara, S. Nakagawa, A. Sakakura, J. Am. Chem. Soc, 127, 4168 (2005).
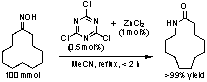
2. Bronsted酸-Lewis塩基複合型Beckmann転位触媒
ラクタムは相当するオキシムのBeckmann転位により工業的に製造される。が大量に副生する。我々は発煙硫酸に代わる触媒として三塩化シアヌリルが極めて有効であることを見つけた。これは世界初のBeckmann転位の有機触媒である。三塩化シアヌリルはオキシム水酸基の脱離を促す。その際、生じる塩酸は助触媒として働く。三塩化シアヌリルと塩化亜鉛を一緒に触媒として用いると更に触媒活性は向上する。例えば、ナイロン12の原料であるラウリルラクタムを0.5 mol%の三塩化シアヌリルと1 mol%の塩化亜鉛を用いて>99%の収率で合成した。
Y. Furuya, K. Ishihara, H. Yamamoto, J. Am. Chem. Soc., 127, 11240 (2005).
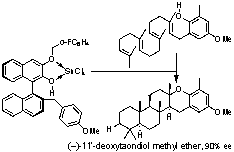
3. Bronsted酸-Lewis酸複合型人工ポリエン環化酵素
ポリエン環化反応は一挙に複数の炭素?炭素結合を立体選択的に導入できるため、多環状テルペノイド類の合成の切り札である。我々は1994年に光学活性ビナフトール(Bronsted酸)とSnCl4(Lewis酸)の配位錯体がシリルエノールエーテルの不斉プロトン化剤となることを報告。これを足がかりに、キラルBronsted酸を人工環化酵素としてエナンチオ選択的ポリエン環化反応に世界で初めて成功。2004年には5員環キレート型キラルBronsted酸を開発し、ゲラニルゲラニルフェノール誘導体から一挙に(-)-taondiol誘導体を90% eeで合成することに成功した。
H. Ishibashi, K. Ishihara, H. Yamamoto, J. Am. Chem. Soc., 126, 11122 (2004).
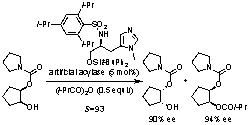
4. Bronsted酸-Lewis塩基複合型不斉アシル化触媒
我々はアシル化酵素の活性中心がヒスチジン残基のイミダゾールであることに着目し、p(Me)-L-ヒスチジノールのアミノ基を嵩高いスルホニルアミノ基に、ヒドロキシ基を嵩高いシリルオキシ基に変換した。こうして出来た分子量660のキラル酸塩基触媒はラセミアルコールとカルボン酸無水物とのアシル化反応による速度論的光学分割に極めて有効であり、その反応速度比[S(kfast/kslow)]は最高132に達した。一つのキラル炭素しか持たない単純な小分子触媒にもかかわらず、Miller (米国)のペプチド触媒を越えるS(kfast/kslow)値を示した。成功の鍵は塩基触媒内のスルホニルアミノ基上の酸性プロトンが基質の一方の鏡像異性体と選択的に水素結合を生じることにある。ペプチド由来の微弱酸性アミドプロトン一つではこの分子認識を実現できない。また、ポリスチレン樹脂担持型触媒の開発にも成功し、回収・再利用も実現。
K. Ishihara, Y. Kosugi, M. Akakura, J. Am. Chem. Soc., 126, 12212 (2004).
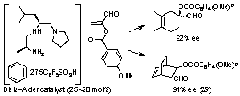
5. Bronsted酸-Lewis塩基複合型不斉Diels-Alder触媒
我々はα-アシロキシアクロレインとジエンの触媒的エナンチオ選択的Diels-Alder反応の開発に初めて成功した。光学活性ジペプチドの還元体であるトリアミンとC6F5SO3Hの有機塩を不斉触媒として用いた。??アシロキシアクロレインはα-ブロモアクロレインの合成等価体として有用であり、本触媒を用いてプロスタグランジンの鍵合成中間体を合成した。触媒設計の鍵は1級アミンの有機塩を触媒として用いた点にある。MacMillan(米国)の2級アンモニウム塩触媒の基質適用範囲が??無置換型アクロレインに限られるのとは対照的である。
K. Ishihara, K. Nakano, J. Am. Chem. Soc., 127, 10504 (2005); corrections: 127, 13079 (2005).
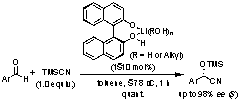
6. Lewis酸-Lewis塩基複合型不斉シアノ化触媒
光学活性シアノヒドリンは医農薬品の重要な中間体である。我々は、アルデヒド類の不斉シアノ化触媒として、光学活性ビナフトールと水酸化リチウムより調製されるリチウムビナフトラート・アクア錯体を開発した。本触媒はリチウムカチオンとビナフトラートアニオンをそれぞれLewis酸及びLewis塩基とする複合触媒であり、その単純な小分子設計にもかかわらず高エナンチオ選択性を発現する。酵素同様、リチウムカチオン近傍の水の水素結合が反応の遷移状態に重要な役割を果たす。
M. Hatano, T. Ikeno, T. Miyamoto, K. Ishihara, J. Am. Chem. Soc., 127, 10776 (2005).







