
波多野Gの研究成果2005〜
▼触媒的エナンチオ選択的アルキル基付加反応による(S)-(-)-ginnolの一段階合成
■A Concise Synthesis of (S)-(+)-Ginnol Based on Catalytic Enantioselective Addition of Commercially Unavailable Di(n-alkyl)zinc to Aldehydes and Ketones
Manabu Hatano, Tomokazu Mizuno, Kazuaki Ishihara
Synlett 2010, (13), 2024–2028. (Cluster, special issue)
DOI: 10.1055/s-0030-1258129
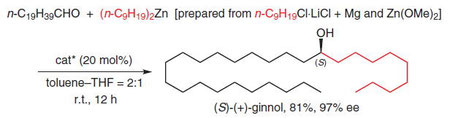
■キラル亜鉛(II)錯体を触媒に用い、グリニャール反応剤と塩化亜鉛から種々の1級アルキル基を持つ有機亜鉛反応剤を系中で調製し、無溶媒条件下でのアルデヒド及びケトンに対する触媒的エナンチオ選択的アルキル基付加反応を開発した。本手法は短鎖から長鎖の幅広い直鎖アルキル基の導入に極めて有効である。本手法を用いて、光学活性な高等植物樹脂である(S)-(-)-ginnolの一段階合成にはじめて成功した。

■ドイツの化学ポータルサイトorganic-chemistry.orgに論文紹介
http://www.organic-chemistry.org/abstracts/lit2/994.shtm
■論文紹介記事が有機合成化学協会誌12月号に掲載(2010, 68(12), pp1329.)
▼マロン酸ジエステル用いる不斉マンニッヒ反応による光学活性β-アミノカルボニル化合物の合成
■Magnesium(II)-Binaphtholate as a Practical Chiral Catalyst for the Enantioselective Direct Mannich-Type Reaction with Malonates
Manabu Hatano, Takahiro Horibe, Kazuaki Ishihara
Org. Lett. 2010, 12(15), 3502–3505.
DOI: 10.1021/ol101353r
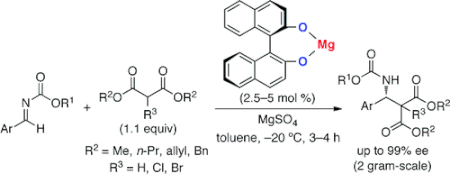
■不斉触媒を用いるアルジミンと1,3-ジカルボニル化合物との直截的不斉マンニッヒ型反応は、有機合成化学において最も重要な不斉炭素-炭素結合生成反応のひとつである。この反応を用いれば、医薬品合成に欠かせない光学活性なβ-ラクタム等が効率的に合成できる。1,3-ジカルボニル化合物の酸性度は、ジケトン、ケトエステル、ジエステルの順に低下するとともに、反応性が著しく低下する。特にジエステルはエノール型になりにくい上、金属触媒を用いた場合には強いキレーションによって金属イオンを補足して触媒活性低下の一因となる。このため、ジエステル化合物(マロン酸ジエステル)は、付加反応に用いる化合物としては開発が困難であった。今回、キラルマグネシウムビナフトラート塩触媒が、アルジミンとジエステル化合物(マロン酸ジエステル)との直截的不斉マンニッヒ反応に有効であることを見出した。対応するβ-アミノカルボニル化合物を高収率・高エナンチオ選択的に得たほか、得られた生成物をβ-ラクタムに誘導した。きわめてシンプルなキラルマグネシウムビナフトラート塩触媒は、プロセス化学を指向したβ-アミノカルボニル化合物合成において、画期的な技術といえる。

■アクセスランキング・イン
■ドイツの化学ポータルサイトorganic-chemistry.orgに論文紹介
http://www.organic-chemistry.org/abstracts/lit2/983.shtm
http://www.organic-chemistry.org/Highlights/2011/11July.shtm
▼グリニャール反応剤を用いるアルデヒド及びケトンに対する触媒的エナンチオ選択的2級アルキル基付加反応
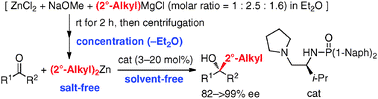
■Catalytic Enantioselective Synthesis of Sterically Demanding Alcohols Using Di(2°-alkyl)zinc Prepared by the Refined Charette’s Method
Manabu Hatano, Tomokazu Mizuno, Kazuaki Ishihara
Chem. Commun. 2010, 46(30), 5443–5445.
DOI: 10.1039/C0CC01301C
■すでに我々は、キラルホスホルアミド-亜鉛(II)錯体を触媒に用い、市販の有機亜鉛反応剤(R2Zn; R = Me, Et, Bu,
Ph)のアルデヒド及びケトンへのエナンチオ選択的付加反応を報告している1。これに対して、2級アルキル基を持つ有機亜鉛反応剤の調製は困難であり、付加反応の報告例の多くは市販のi-Pr2Znによるイソプロビル化に限られている。今回、グリニャール反応剤と塩化亜鉛から種々の2級アルキル基を持つ有機亜鉛反応剤を系中で初めて調製し、無溶媒条件下でのアルデヒド及びケトンに対する触媒的エナンチオ選択的2級アルキル基付加反応を開発した。
Charetteらの方法に改良を加え、グリニャール反応剤、塩化亜鉛、ナトリウムメトキシドから種々の2級アルキル基を持つ有機亜鉛反応剤をエーテル溶媒中で調製した。遠心分離の後、上澄み液からエーテルを留去して無溶媒の有機亜鉛反応剤とした。これらの有機亜鉛反応剤を用いて、10
mol%のキラルホスホルアミド存在下、無溶媒条件でアルデヒドに対するエナンチオ選択的2級アルキル基付加反応を検討した。その結果、種々の芳香族及び脂肪族アルデヒドから対応する光学活性第2級アルコールを高収率・高エナンチオ選択的に得ることに成功した。本法は不斉還元法では合成が困難な光学活性第2級アルコールの合成にも有効である。得られた光学活性化合物の誘導も検討した。

▼高活性亜鉛アート触媒によるケトンへの高効率グリニャール付加反応と反応機構の考察
■Zinc(II)-Catalyzed Addition of Grignard Reagents to Ketones
Manabu Hatano, Orie Ito, Shinji Suzuki, Kazuaki Ishihara
J. Org. Chem. 2010, 75(15), 5008–5016.
DOI: 10.1021/jo100563p
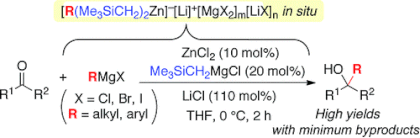
■ケトンに対するグリニャール付加反応は、第3級アルコールを得る最も簡便な方法として広く用いられているが、多くの副反応を生じることが問題である。当研究室では、ケトンに対するグリニャール付加反応において10 mol%の塩化亜鉛を添加することで、触媒的亜鉛(II)アート錯体反応剤を系中で形成させ、副反応を抑制して第3級アルコールを高収率・高化学選択的に得ることに成功している。しかし、使用できるグリニャール反応剤は塩化物(RMgCl; R = alkyl)に限られていた。これに対して、塩化リチウム存在下、トリメチルシリルメチル(Me3SiCH2)基を含む高活性亜鉛(II)アート錯体を触媒に用いると、種々のグリニャール反応剤(RMgX; X = Cl, Br, I; R = alkyl, aryl)に適用可能となった。今回我々は、塩化リチウムの添加効果を解明するために、種々のアルカリ金属ハライド塩存在下、ケトンに対する触媒的グリニャール付加反応を検討した。その結果、塩化リチウムの顕著な塩効果が、リチウムイオンに基づくカチオン効果と、塩化物イオンに基づくハライド効果に起因することが明らかとなった。トリメチルシリルメチル基の効果や、塩効果を踏まえて予想できる反応活性中間体および触媒サイクルについても考察した。

■アクセスランキング・イン
■ドイツの化学ポータルサイトorganic-chemistry.orgに論文紹介
▼直截的不斉マンニッヒ型反応に有効なキラルリン酸カルシウム塩触媒とキラルリン酸触媒
■Which is the Actual Catalyst: Chiral Phosphoric Acid or Chiral Calcium Phosphate?
Manabu Hatano, Katsuhiko Moriyama, Toshikatsu Maki, Kazuaki Ishihara
Angew. Chem., Int. Ed. 2010, 49(22), 3823–3826.
DOI: 10.1002/anie.201000824
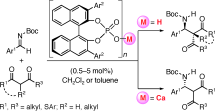
■アルジミンと1,3-ジカルボニル化合物の直截的不斉マンニッヒ型反応に有効な酸塩基複合塩触媒となるキラルリン酸カルシウム塩触媒を開発した。高活性な本触媒は様々な1,3-ジカルボニル化合物の付加反応を促進した。とくに、これまで例がないチオエステル類の直截付加に極めて有効であり、生成物の有用な化学変換に成功した。また、嵩高いリン酸触媒(有機触媒)も本反応を効率よく促進することを確認した。興味深いことに、同じ軸不斉を有するキラルリン酸触媒とキラルリン酸カルシウム塩触媒から互いに逆の絶対立体配置をもつ生成物が得られた。

■表紙に採用
■アクセスランキング・イン
■中日新聞(2010年4月23日)「カルシウム使い『不斉合成』促進-触媒の大量生産に道」
■Synfacts 2010, (7), 834に論文紹介

▼光学活性3,3’-二置換ビナフチルジスルホン酸の合成
■Synthesis of Chiral 3,3’-Disubstituted 1,1’-Binaphthyl-2,2’-disulfonic acids
Manabu Hatano, Yoshihiro Sugiura, Kazuaki Ishihara
Tetrahedron: Asymmetry 2010, 21(21–22), 1311–1314.
DOI: 10.1016/j.tetasy.2010.03.014

■我々は既に光学活性1,1’-ビナフチル-2,2’-ジスルホン酸(BINSA)の効率的合成に成功し、そのアンモニウム塩及び金属塩をキラル触媒とする不斉触媒反応の開発に成功している。一般に、ビナフトール(BINOL)をはじめとする光学活性ビナフチル化合物への3,3’位への置換基導入は、立体的及び電子的効果からキラル触媒創製の常套手段となっている。そこで今回、BINSAの3,3’位への種々の置換基導入を検討した。その結果、シリル基やボリル基をはじめとする種々の置換基導入に成功した。

▼高活性亜鉛アート錯体を触媒とするケトンへの高効率グリニャール付加反応
■Zinc(II)-catalyzed Grignard Additions to Ketones with RMgBr and RMgI
Manabu Hatano, Orie Ito, Shinji Suzuki, Kazuaki Ishihara
Chem. Commun. 2010, 46(15), 2674–2676.
DOI: 10.1039/B926243A
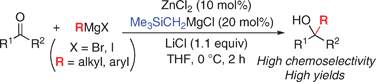
■すでに我々は、ケトンに対するグリニャール付加反応において、10 mol%の塩化亜鉛を添加することで、触媒的亜鉛(II)アート錯体反応剤を系中で形成させ、副反応を抑制して第3級アルコールを高収率・高化学選択的に得ることに成功している。しかし、使用できるグリニャール反応剤は塩化物(RMgCl; R = alkyl)に限られていた。これに対して、塩化リチウム存在下、トリメチルシリルメチル(Me3SiCH2)基を含む高活性亜鉛(II)アート錯体を触媒に用いると、種々のグリニャール反応剤(RMgX; X = Cl, Br, I; R = alkyl, aryl)に適用可能となった。

▼グリニャール反応剤由来の亜鉛アート錯体を用いるケトンへの高化学選択的アルキル付加反応
■Highly Chemoselective Stoichiometric Alkylation of Ketones with Grignard Reagent Derived Zinc(II) Ate Complexes
Manabu Hatano, Shinji Suzuki, Kazuaki Ishihara
Synlett 2010, (2), 321–324. (Cluster, special issue)
DOI: 10.1055/s-0029-1219220
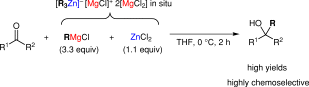
■マグネシウムアート錯体の調製には不安定なアルキルリチウム反応剤が必要である。また、塩化亜鉛を用いる触媒的グリニャール反応では、触媒に対して過剰に存在するグリニャール反応剤によって触媒が関与しない競争的な正反応と副反応が併発するため、化学選択性が不充分な場合がある。そこで、グリニャール反応剤と塩化亜鉛から調製できる亜鉛アート錯体を等モル量用いるケトンへの高化学選択的第3級アルコール合成法を開発した。塩化亜鉛(1.1当量)とグリニャール反応剤(3.3当量)を、THF中室温にて撹拌することにより、種々の亜鉛アート錯体を系中で調製した。その後THF中0℃にてケトンを加えて2時間反応させた。その結果、副生成物を最少限に抑え、目的とする第3級アルコールを高収率、高化学選択的に合成することに成功した。

▼synまたはanti選択的直截的不斉マンニッヒ型反応に有効なキラルリチウムビナフトラート塩触媒の設計
■Chiral Lithium(I) Binaphtholate Salts for the Enantioselective Direct Mannich-Type Reaction with a Change of Syn/Anti and Absolute Stereochemistry
Manabu Hatano, Takahiro Horibe, Kazuaki Ishihara
J. Am. Chem. Soc. 2010, 132(1), 56–57.
DOI: 10.1021/ja909874b
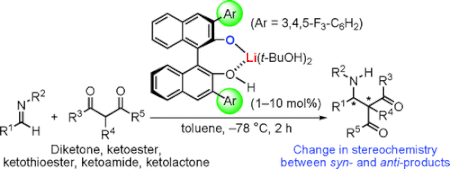
■アルジミンと1,3-ジカルボニル化合物の直截的不斉マンニッヒ型反応に有効な酸塩基複合塩触媒となるキラルリチウムビナフトラート塩を開発した。高活性な本触媒は様々な1,3-ジカルボニル化合物の付加反応を促進し、3分から2時間で高収率、高エナンチオ選択的に生成物を得た。環状1,3-ジカルボニル化合物からはsyn選択的に生成物を得たのに対し、鎖状1,3-ジカルボニル化合物からは初めてanti選択的に生成物を得ることに成功した。

■Synfacts 2010, (4), 445に論文紹介
▼ランタン(III)ビナフチルジスルホナート錯体を不斉触媒とするエナンチオ選択的ストレッカー型反応
■Chiral Lanthanum(III)-Binaphthyldisulfonate Complexes for Catalytic Enantioselective Strecker Reaction
Manabu Hatano, Yasushi Hattori, Yoshiro Furuya, Kazuaki Ishihara
Org. Lett. 2009, 11(11), 2321–2324.
DOI: 10.1021/ol900680f

■1,1’-ビナフチル-2,2’-ジスルホン酸(BINSA)の有機触媒的アプローチに加え、不斉金属触媒的なアプローチを検討した。その結果、ランタン (III)ビナフチルジスルホナート錯体がエナンチオ選択的ストレッカー型反応に有効な触媒であることを発見した。La(OPh)3と1,1’-ビナフチ ル-2,2’-ジスルホン酸から系中で調製したランタン(III)ビナフチルジスルホナート錯体存在下、嵩高い保護基を持つアルジミン基質とトリメチルシ リルシアニドを用いた不斉ストレッカー型反応を検討した。特に酢酸またはイソ酪酸をを50mol%添加すると、プロピオニトリル中-20℃で反応が円滑に 進行し、高収率・高エナンチオ選択的に対応するシアノ化生成物を得ることに成功した。予想される反応機構や遷移状態についても考察した。

■Synfacts 2009, (9), 989に論文紹介
▼カリウムアルコキシド-クラウンエーテル触媒を用いる官能基を含む第三級アルコール合成
■Highly Efficient Synthesis of Functionalized Tertiary Alcohols Catalyzed by Potassium Alkoxide–Crown Ether Complexes
Manabu Hatano, Shinji Suzuki, Eri Takagi, Kazuaki Ishihara
Tetrahedron Lett. 2009, 50(26), 3171–3174.
DOI: 10.1016/j.tetlet.2009.01.028

■カリウムアルコキシド-クラウンエーテル触媒をルイス塩基として用いるケトンとトリメチルシリルエノラートの向山アルドール反応による高効率第三級アルドール合成に成功した。本反応システムでは、問題となる逆アルドール反応を完全に抑えることができる。本触媒システムは、他のトリメチルシリル反応剤とケトン及びアルジミンとの反応も円滑に促進する。たとえば、シリルトリフルオロメチル化やシアノシリル化、シアノホスホリル化などが挙げられる。面白いことに、本触媒は強力なブレンステッド塩基触媒としても機能し、前例のないケトンへの直截的ヒドロホスホニル化反応が高収率で進行した。

▼キラルビナフチルスルホン酸ピリジニウム塩触媒を用いるエナンチオ選択的マンニッヒ反応
■Pyridinium 1,1’-Binaphthyl-2,2’-disulfonates as Highly Effective Chiral Bronsted Acid–Base Combined Salt Catalysts for Enantioselective Mannich-Type Reaction
Manabu Hatano, Toshikatsu Maki, Katsuhiko Moriyama, Manabu Arinobe, Kazuaki Ishihara
J. Am. Chem. Soc. 2008, 130(50), 16858–16860.
DOI: 10.1021/ja806875c

■近年、キラルリン酸触媒による不斉合成反応の報告が数多くなされている。これら触媒の不斉源はビナフトールであり、3,3’-位へ嵩高い置換基を導入することによって効果的に不斉場を構築している。一方、スルホン酸はその強い酸性度からブレンステッド酸触媒として汎用されているが、キラルスルホン酸をブレンステッド酸触媒として用いた不斉反応の報告例はない。 そこで我々は軸不斉を有する1,1’-ビナフチル-2,2’-ジスルホン酸と3級アミンとのアンモニウム塩をキラルブレンステッド酸触媒として設計した。このとき、用いるアミンによってアンモニウム塩の酸性度の制御が可能であり、かつアミンの立体が不斉場の構築に大きく役立つことが期待できる。検討の結果、1,1’-ビナフチル-2,2’-ジスルホン酸と2,6-ジフェニルピリジンとのアンモニウム塩が極めて有効な不斉触媒となることを見出した。本触媒を用いて1,3-ジケトンとN-アシルイミンとの直接的マンニッヒ反応を試みたところ、わずか1 mol%の触媒を用いるだけで高収率、高エナンチオ選択的にb-アミノカルボキシル化合物を得ることに成功した。

■Synfacts 2009, (2), 207に論文紹介
■ドイツの化学ポータルサイトorganic-chemistry.orgに論文紹介
▼ケトンへのエナンチオ選択的シアノ化反応に有効なキラルリン酸リチウム塩の開発
■Chiral Lithium Salts of Phosphoric Acids as Lewis Acid–Base Conjugate Catalysts for the Enantioselective Cyanosilylation of Ketones
Manabu Hatano, Takumi Ikeno, Tokihiko Matsumura, Shinobu Torii, Kazuaki Ishihara
Adv. Synth. Catal. 2008, 350(11–12), 1776–1780.
DOI: 10.1002/adsc.200800314

■ケトンへのシアノシリル化反応に有効なキラルリン酸リチウム塩の開発に成功した。10 mol%の本触媒存在下、反応は円滑に進行し、対応する生成物を高収率、高エナンチオ選択的に得ることに成功した。本成果は、キラルリン酸のリチウム塩を用いる反応として初めての例である。

▼ビナフトール由来のキラル第一級ジアミンを不斉配位子とする銅(I)触媒によるアルジミンのエナンチオ選択的アルキニル化反応
■Enantioselective Alkynylation to Aldimines Catalyzed by Chiral 2,2’-Di(2-aminoaryloxy)-1,1’-binaphthyl-copper(I) Complexes
Manabu Hatano, Takafumi Asai, Kazuaki Ishihara
Tetrahedron Lett. 2008, 49(2), 379–382.
DOI: 10.1016/j.tetlet.2007.11.032

■安価なビナフトールから容易に誘導できる新規キラル第一級ジアミンを収率よく合成した。これらを不斉配位子とするキラル銅(I)触媒による末端アルキン化合物のアルジミンへのエナンチオ選択的付加反応を開発した。特にパラ位に塩素原子を導入したアニリンをもつキラル配位子が有効で、82%eeで対応する付加生成物を得ることに成功した。

▼キラルビナフチルジアミン銅(I)錯体を触媒とするジアルキル亜鉛のエノンへの共役付加反応
■Enantioselective Conjugate Addition of Dialkylzinc to Cyclic Enones Catalyzed by Chiral Binaphthyldiamine-Copper(I) Complexes
Manabu Hatano, Takafumi Asai, Kazuaki Ishihara
Tetrahedron Lett. 2007, 48(49), 8590–8594.
DOI: 10.1016/j.tetlet.2007.10.061

■軸不斉を持つシンプルな(S)-1,1-ビナフチル-2,2’-ジアミンを不斉配位子として用いるキラル銅(I)触媒による有機亜鉛試薬の不飽和エノンへのエナンチオ選択的1,4-付加反応を開発した。(S)-1,1-ビナフチル-2,2’-ジアミンは、系中でジアルキル亜鉛により脱プロトン化され、窒素原子上に有意な置換基効果をもたらす。これにより、Cu(I)上でエノンのC=C部位を、Zn(II)上でエノンのC=O部位をそれぞれ活性化する。興味深いことに、添加剤としてアキラルな第一級アミン(2,9-ジフェニルアニリン))を触媒量加えることで収率およびエナンチオ選択性が大幅に向上した。

▼キラル亜鉛(II)触媒を用いる光学活性第3級アルコールの高効率合成
■Highly Active Chiral Phosphoramide-Zn(II) Complexes as Conjugate Acid–Base Catalysts for Enantioselective Organozinc Addition to Ketones
Manabu Hatano, Takashi Miyamoto, Kazuaki Ishihara
Org. Lett. 2007, 9(22), 4535–4538.
DOI: 10.1021/ol702074a
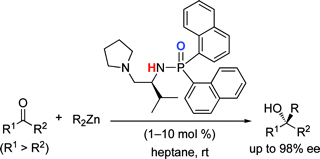
■光学活性第3級アルコールは、天然物・及び医薬品合成において種々のキラル化合物に容易に導かれるため、有機合成上重要である。我々は有機亜鉛試薬によるケトンへのアルキル付加、フェニル付加反応において極めて有効なL-バリン由来の新規キラル亜鉛(II)触媒を開発した。本触媒は、ホスホリル基のルイス塩基性と亜鉛(II)中心のルイス酸性を駆使した高活性キラル酸塩基複合型亜鉛(II)触媒である。検討の結果、幅広い芳香族・脂肪族ケトンに対して、チタンなどの添加剤を一切用いることなく、高収率・高エナンチオ選択的に対応する光学活性第3級アルコールを得ることに成功した。

■ドイツの化学ポータルサイトorganic-chemistry.orgに論文紹介
▼高活性ルイス塩基触媒を用いるケトンに対する向山アルドール反応の開発
■Sodium Phenoxide-Phosphine Oxides as Extremely Active Lewis Base Catalysts for the Mukaiyama Aldol Reaction with Ketones
Manabu Hatano, Eri Takagi, Kazuaki Ishihara
Org. Lett. 2007, 9(22), 4527–4530.
DOI: 10.1021/ol702052r
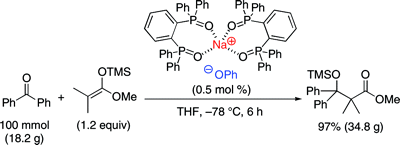
■有機ケイ素求核剤はルイス塩基触媒によって活性化されるが、ケトンを求電子剤とする触媒反応の開発は未だ困難である。特に、安定で取り扱いが容易な一般的なトリメチルシリル化合物を求核剤にすることができれば、当該反応の汎用性は格段に向上する。本論文では、トリメチルシリルエノラートのケトンへの求核付加反応を可能にするホスフィンオキシド-アルカリ金属塩触媒を開発した。これらの触媒は、トリメチルシリルエノラートを活性化し、ケトンへの向山アルドール反応に極めて有効であり、対応する第3級アルドール生成物を高収率で得ることに成功した。さらに、同触媒はアルジミンを基質とするMannich型反応にも有効で、対応するアミン生成物を高収率で得ることに成功した。

■ドイツの化学ポータルサイトorganic-chemistry.orgに論文紹介記事
http://www.organic-chemistry.org/abstracts/lit1/894.shtm
■Aldrich ChemFilesに研究紹介 Aldrich ChemFiles 2010, 10(2), 17–18.]
▼新規ジスルホン酸を追アニオンとする新規ルイス酸(スカンジウム、ランタノイド類)の触媒設計
■Dimeric Scandium(III) and Monomeric Lanthanide(III) Complexes with Perfluoropropane-1,3-disulfonates as Counter Anions for Lewis Acid Catalysis
Manabu Hatano, Eri Takagi, Manabu Arinobe, Kazuaki Ishihara
J. Orgamometal. Chem. 2007, 692(1–3), 569–578.
DOI: 10.1016/j.jorganchem.2006.05.057
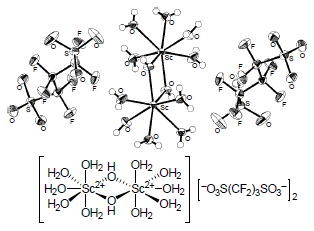
■含フッ素モノスルホナート[CF3(CF2)nSO3-]はフッ素原子の強い電気陰性度に基づき、プロトンのブレステッド酸性または中心金属イオンのル イス酸性を向上させる小分子モノマー触媒の対アニオンとして知られている。一方、同一分子内に2つ以上のスルホナート(SO3-)を有する含フッ素小分子 化合物から超強酸性触媒・材料を合成した例は無い。本論文では新規含フッ素ジスルホナート[-O3S(CF2)3SO3-]を対アニオンとする超分子型金 属ポリマー触媒(スカンジウム、ランタノイドなど)の合成に成功した。これらの触媒の合成は、自己組織化を超分子化の駆動源とする独創的なナノ構造構築法 を用いている。特に本研究開発では、ジスルホン酸の2つのスルホナートを分子間で連続的に結合させることが触媒性材料づくりのブレイクスルーとなってお り、従来のモノスルホン酸では不可能な独創的な触媒設計を実現した。

▼塩化亜鉛触媒とGrignard試薬によるケトン、イミンの効率的アルキル化反応
■Highly Efficient Alkylation to Ketones and Aldimines with Grignard Reagents Catalyzed by Zinc(II) Chloride
Manabu Hatano, Shinji Suzuki, Kazuaki Ishihara
J. Am. Chem. Soc. 2006, 128(31), 9998–9999.
DOI: 10.1021/ja0628405

■第3級アルコールは工業的にはケトンのアルキル化で合成する。しかし、一般的にアルドール反応や還元反応などの副反応が併発して収率が低い。そこで本研究では、諸問題の原因となるアルキル化剤の塩基性を抑え、なおかつ高い求核性をもつ亜鉛アート錯体触媒/反応剤に着目した。Grignard試薬を用いる従来のアルキル化の工程に10mol%の塩化亜鉛(ZnCl2)を添加することで、副反応が抑制され、目的とする第3級アルコールの著しい収率向上に成功した。レジスト原料となる2-アルキル-2-アダマンタノールのグラムスケール合成(100mmol)も円滑に進行した。本アルキル化はアルジミン基質にも有効で、対応する第2級アミンを高収率で得ることに成功した。Grignard試薬を用いる第3級アルコール・第2級アミンの高効率大量合成プロセスとして特筆に価する。

■アクセスランキング第1位
■Synfacts 2006, (11), 1166に論文紹介
■ドイツの化学ポータルサイトorganic-chemistry.orgに論文紹介
http://www.organic-chemistry.org/abstracts/lit1/379.shtm
■有機合成化学協会誌, 2008, 66, 1012.「ケミカルズ覚え書き」で研究紹介
▼アルデヒドの項エナンチオ選択的アルキル化反応に有効な共役系酸塩基複合型キラル亜鉛触媒の設計
■3,3’-Diphosphoryl-1,1’-bi-2-naphthol–Zn(II) Complexes as Conjugated Acid–Base Catalysts for Enantioselective Dialkylzinc Addition to Aldehydes
Manabu Hatano, Takashi Miyamoto, Kazuaki Ishihara
J. Org. Chem. 2006, 71(17), 6474–6484.
DOI: 10.1021/jo060908t
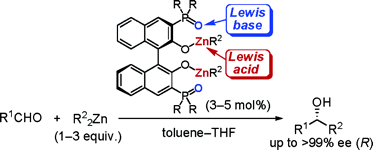
■Enantioselective Dialkylzinc Addition to Aldehydes Catalyzed by Chiral Zn(II)-BINOLates Bearing Phosphonates and Phosphoramides in the 3,3’-Positions
Manabu Hatano, Takashi Miyamoto, Kazuaki Ishihara
Synlett 2006, (11), 1762–1764.
DOI: 10.1055/s-2006-944201
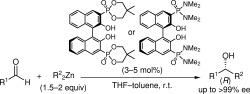
■有機亜鉛試薬を用いたカルボニル化合物へのエナンチオ選択的付加反応に有効な新しい触媒設計として、共役系酸塩基複合型キラル亜鉛錯体触媒を創製した。ビナフトラート-亜鉛(II)とホスホリル酸素をそれぞれルイス酸・ルイス塩基部位としてデザインし、しかも両活性部位を共役結合で繋げた。この新しいデザインにより炭素-炭素結合時の一電子移動を触媒内部で行うことで、キラル触媒の高活性化の促進に成功した。チタン等の添加物を加えずに触媒量はわずか3mol%まで低減することに成功した。特にリンアミド型触媒は高活性で、種々のアルデヒドにおいて高収率・高エナンチオ選択的アルキル化に成功した。

■Synfacts 2006, (11), 1129に論文紹介
■ドイツの化学ポータルサイトorganic-chemistry.orgに論文紹介
▼自己組織化を用いたキラル超分子錯体触媒の開発
■Design of Chiral Macrocyclic Complexes Based on trans-Chelation of n:n Metal–Bidentate P,N- or N,N-Ligands
Manabu Hatano, Takafumi Asai, Kazuaki Ishihara
Chem. Lett. 2006, 35(2), 172–173.
DOI: 10.1246/cl.2006.172
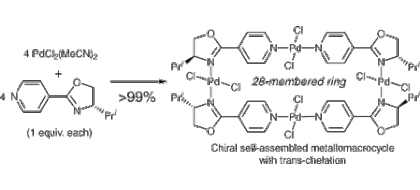
■現在の不斉触媒反応はその大半が比較的小さい単核錯体まわりでの不斉配位子による単独立体制御の手法を用いたものである。一方、複数の小さな金属錯体を組み合わせることが出来れば、いわば酵素反応のような基質との多点配位を鍵とした高度かつ高効率的な立体化学制御を、不斉金属触媒反応において発現させることが出来ると考えられる。本研究は、小分子パーツから構成される“超分子構造型”不斉遷移金属錯体を創製し、従来とは全く異なる配位形式や特異なキラルビルディングブロックを活用することで、新たな不斉触媒反応の開発を行なった。ベンゼン環のパラ位どうしにキラルオキサゾリンを導入した新規配位子を用いて、中心金属をパラジウム・白金・銅とする自己組織化錯体の合成に成功した。既存の手法では構築が困難な『トランス・キレート型錯体』が、自己組織化・超分子化の手法により多核錯体として極めて容易に構築できることを明らかにした。

▼リン含有キラルビナフトール亜鉛触媒を用いるアルデヒドの高エナンチオ選択的アルキル化反応
■Enantioselective Addition of Organozinc Reagents to Aldehydes Catalyzed by 3,3’-Bis(diphenylphosphinyl)-BINOL
Manabu Hatano, Takashi Miyamoto, Kazuaki Ishihara
Adv. Synth. Catal. 2005, 347(11–13), 1561–1568.
DOI: 10.1002/adsc.200505221
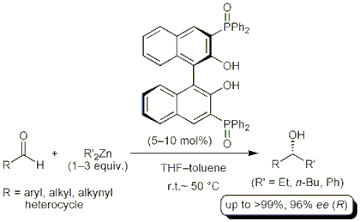
■有機亜鉛試薬を用いたカルボニル化合物へのエナンチオ選択的付加反応は、重要な不斉炭素-炭素結合生成反応の一つである。特にBINOL誘導体は優れた不斉配位子として作用することが報告されているが、多くの場合、過剰量のアルキル化剤および添加剤として別の不斉配位子やチタン試薬が必要である。我々は、ホスフィンオキシドを鍵部位として有する種々の新規BINOL系不斉配位子を合成し、一切の添加剤を加えない有機亜鉛試薬によるアルデヒドへの高エナンチオ選択的付加反応に成功したの。P(=O)Ph2を含有する新規リン含有BINOL誘導体は優れた触媒活性を示し、芳香族、脂肪族アルデヒドともに高収率・高エナンチオ選択的に進行した(>99%, 96%ee)。さらに本触媒は、通常は行なわない加熱条件(50℃)において触媒活性が大幅に向上し、触媒量やアルキル化剤の量を減らしても対応する付加生成物を高収率・高エナンチオ選択的に得ることに成功した。

▼水を助触媒とするビナフトール-リチウム触媒を用いた高エナンチオ選択的シアノ化反応
■Chiral Lithium Binaphtholate Aqua Complex as a Highly Effective Asymmetric Catalyst for Cyanohydrin Synthesis
Manabu Hatano, Takumi Ikeno, Takashi Miyamoto, Kazuaki Ishihara
J. Am. Chem. Soc. 2005, 127(31), 10776–10777.
DOI: 10.1021/ja051125c
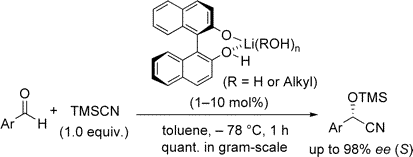
■カルボニル類の不斉触媒的シアノ化反応は、種々の有用化合物に導く光学活性シアノヒドリンを得る、有機合成上重要な不斉炭素-炭素結合生成反応である。通常はキラルルイス酸触媒が用いられるが、キラルルイス塩基を触媒とするアルデヒドの不斉シアノ化はKaganの報告に限られてきた。我々は、ビナフトール-リチウム錯体をルイス塩基触媒とするアルデヒドの不斉シアノ化反応において、助触媒として触媒量の水またはアルコールを添加することで、定量的かつ高エナンチオ選択的(>99%収率、98%ee)なシアノヒドリン合成に成功した。興味深いことに、同じ(R)-BINOLを用いても、得られる生成物は無水条件の場合と立体選択性が逆転した(R体65%eeからS体97%ee)。安価で入手容易なBINOLとLiOi-Prから簡単に調製できる本触媒は極めて高活性で、1mol%の触媒量で種々の芳香族アルデヒドから90%ee以上の高いエナンチオ選択性で対応するシアノヒドリンをグラムスケールで定量的に得ることができ、プロセス化学としても実用的な反応開発である。

■Syntacts (2005, (2), 228)に論文紹介
■有機合成化学協会誌(2006, 64, 79)に論文紹介
■ドイツの化学ポータルサイトorganic-chemistry.orgに論文紹介
▼マグネシウムアート錯体を用いたケトン類へのアルキル基選択的付加反応の開発
■Highly Selective Alkylation to Ketones with Magnesium Ate Complexes Derived from Grignard Reagents
Manabu Hatano, Tokihiko Matsumura, Kazuaki Ishihara
Org. Lett. 2005, 7(4), 573–576.
DOI: 10.1021/ol047685i

■古典化学に端を発するアルキルリチウム試薬またはGrignard(グリニャール)試薬は、有機化学の初期発展に大きく寄与し、今もなお重要な炭素-炭素結合生成法のひとつとして常用されている。しかしながらこれらのアルキル化剤は、高すぎる反応活性を有することから不安定で取り扱いが危険であったり、反応の制御が困難な場合があり、望むカルボニル化合物のアルキル化に対し、アルドール反応や還元反応などの副反応が併発することが知られている。そこで、古くて新しいマグネシウムアート錯体(R3MgLiまたはR1R22MgLi)に着目し、カルボニル化合物へのアルキル基選択的付加反応を開発した。

■有機合成化学協会誌(2005, 63, 748)に論文紹介
■ドイツの化学ポータルサイトorganic-chemistry.orgに論文紹介
http://www.organic-chemistry.org/abstracts/literature/846.shtm







